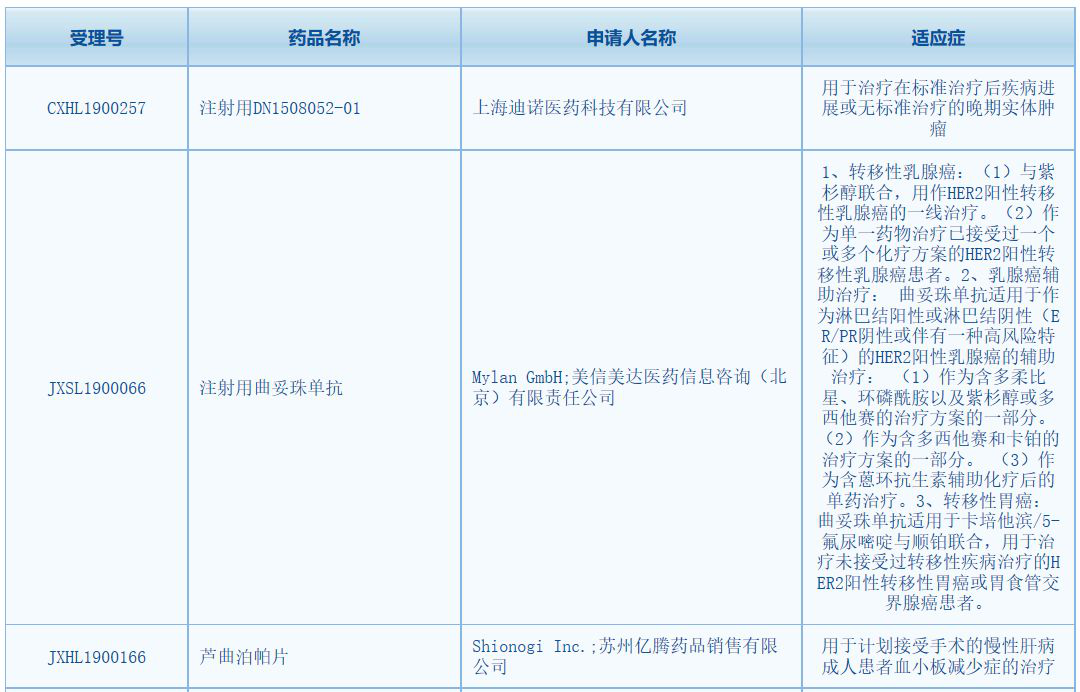
10月14日,中國國家藥監(jiān)局藥品審評中心(CDE)公示�����,三款新藥臨床試驗申請獲得臨床試驗?zāi)驹S可�。分別為上海迪諾醫(yī)藥的TLR8激動劑DN1508052-01�,邁蘭(Mylan GmbH)和美信美達醫(yī)藥的注射用曲妥珠單抗,以及蘇州億騰藥品的TPO-R激動劑蘆曲泊帕片�。值得一提的是,DN1508052-01是中國首個獲得臨床試驗許可的TLR8激動劑�;邁蘭的曲妥珠單抗則為美國FDA首個批準(zhǔn)的曲妥珠單抗生物類似藥。
DN1508052-01是由上海迪諾醫(yī)藥開發(fā)的一款高效的小分子Toll樣受體8(TLR8)激動劑�����,用于癌癥免疫治療�����。該產(chǎn)品于2018年11月收到美國FDA已完成DN1508052新藥臨床研究申請(IND)審核的信函。根據(jù)ClinicalTrials網(wǎng)站���,目前該公司已啟動了一項開放���、多中心的1期臨床試驗,以初步評估該產(chǎn)品單藥經(jīng)皮下注射用于實體瘤患者的安全耐受�、藥物代謝動力學(xué)特性及抗腫瘤活性。
TLR受體是先天免疫系統(tǒng)中重要的一部分�,激活這些受體能夠在腫瘤微環(huán)境中改善樹突狀細胞和巨噬細胞的抗原呈現(xiàn),并且促進CD8+ T細胞的增殖�。在TLRs家族中共有13種TLR,其中TLR8與自身免疫性疾病密切相關(guān)�����,主要表達于單核細胞��、巨噬細胞�����、及髓系樹突狀細胞�����,應(yīng)用前景十分廣闊,是腫瘤免疫治療領(lǐng)域的新星��。
此次DN1508052-01在中國獲批臨床��,擬開發(fā)適應(yīng)癥為:用于治療在標(biāo)準(zhǔn)治療后疾病進展或無標(biāo)準(zhǔn)治療的晚期實體腫瘤�。據(jù)了解,這也是首個在中國獲得臨床試驗批準(zhǔn)的TLR8激動劑�。在全球,TLR8激動劑的開發(fā)領(lǐng)域進度較快的有吉利德科學(xué)(Gilead)旗下的GS-9688�����,目前該產(chǎn)品處于2期臨床階段��,擬開發(fā)用于慢性乙型肝炎的治療���。
上海迪諾醫(yī)藥致力于癌癥領(lǐng)域臨床未滿足藥物的研究與開發(fā)。目前�,該公司正積極推進其自主研發(fā)的TLR8激動劑,PARP抑制劑及IDO1/TDO2雙靶點抑制劑的臨床研究�����。同時,還在擴充包括腫瘤免疫治療�,DNA損傷修復(fù)及細胞周期免疫檢測點通路在內(nèi)的自主研發(fā)項目,以提供有效的抗腫瘤治療藥物及更好的患者預(yù)后�����。
曲妥珠單抗是一款專門針對HER2陽性乳腺癌的分子靶向治療藥物��。原研產(chǎn)品赫賽汀從1998年首次上市至2018年�����,累計銷售額達879.7億美元�,是全球知名的十大暢銷藥品之一。該藥預(yù)計2024年累計銷售額將達到1148.9億美元��。2002年��,赫賽汀在中國獲批上市���,獲批適應(yīng)癥包括轉(zhuǎn)移性乳腺癌���、乳腺癌輔助治療、轉(zhuǎn)移性胃癌等���。
此次由邁蘭(Mylan GmbH)和美信美達醫(yī)藥共同提交且獲得臨床試驗?zāi)驹S可的曲妥珠單抗�����,是一款生物類似藥��,擬開發(fā)適應(yīng)癥與赫賽汀已獲批的適應(yīng)癥完全一致�����。事實上�����,來自邁蘭和Biocon的曲妥珠單抗生物類似藥Ogivir早在2017年12月就獲得美國FDA批準(zhǔn)上市�,成為了首個在美獲批的曲妥珠單抗生物類似藥。
作為全球暢銷藥��,一直以來針對曲妥珠單抗生物類似藥的研發(fā)和申報就是一大熱點���。在美國,已有多款曲妥珠單抗生物類似藥獲得批準(zhǔn)�,除了邁蘭的Ogivi,還有三星Bioepis的Ontruzant���,安進(Amgen)和艾爾建(Allergan)的KANJINTI��,以及Celltrion公司的的Herzuma等���。
目前���,中國尚未有曲妥珠單抗生物類似藥獲批。不過已有三生國健和復(fù)宏漢霖兩家企業(yè)向CDE申報了曲妥珠單抗生物類似藥的上市申請�����。其中�,復(fù)宏漢霖的曲妥珠單抗生物類似藥HLX02上市申請還被CDE納入優(yōu)先審評。另有恒瑞醫(yī)藥�����、嘉和生物�、百奧泰等多家企業(yè)的同類產(chǎn)品正處于3期臨床試驗階段。
蘆曲泊帕(lusutrombopag)是一種口服的�、小分子的人血小板生成素受體激動劑(TPO-R),可誘發(fā)內(nèi)源性血小板生成���。它能與巨核細胞表面的TPO受體相結(jié)合�,誘導(dǎo)這些細胞的增殖、分化與成熟�����,從而上調(diào)血小板的產(chǎn)生�����。今年6月�,鹽野義制藥宣布與億騰醫(yī)藥達成協(xié)議,億騰醫(yī)藥將獲得在中國大陸���、香港和澳門對蘆曲泊帕的獨家授權(quán)引進許可��。

血小板減少癥是慢性肝臟疾病的常見并發(fā)癥�����,可能由多種因素引起���。患有這種疾病的患者其出血風(fēng)險會顯著增加��,需要反復(fù)輸注血小板以控制病情�。這給他們帶來了極大的醫(yī)療負擔(dān):據(jù)統(tǒng)計,患有血小板減少癥的丙肝患者���,每年的醫(yī)療費用是沒有血小板減少癥的患者的三倍��!此外�,由于血小板的缺少��,這些患者的常規(guī)護理會變得相當(dāng)復(fù)雜——常規(guī)的肝臟活檢或是手術(shù)�,其出血狀況都會得到加重。這也往往導(dǎo)致正常醫(yī)療護理的延遲或取消��。對這些患者來說�����,他們急需一種新的治療方法來改善現(xiàn)狀���。
此前���,蘆曲泊帕已被批準(zhǔn)在美國、歐盟和日本上市�����,作為常規(guī)藥物在臨床使用。此次該藥在中國獲批臨床�,擬開發(fā)適應(yīng)癥為:用于計劃接受手術(shù)的慢性肝病成人患者血小板減少癥的治療。值得一提的是���,目前中國已有諾華(Novartis)的艾曲泊帕�、三生制藥的血小板生成素等TPO-R類藥物獲批上市���。另有恒瑞醫(yī)藥的海曲泊帕��、復(fù)星醫(yī)藥引進的阿伐曲泊帕正在3期臨床階段���。



