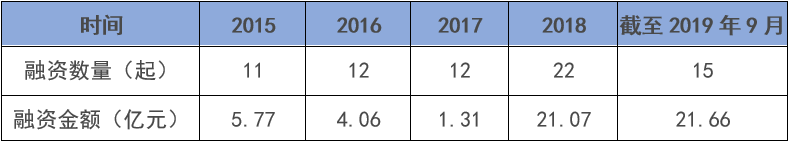
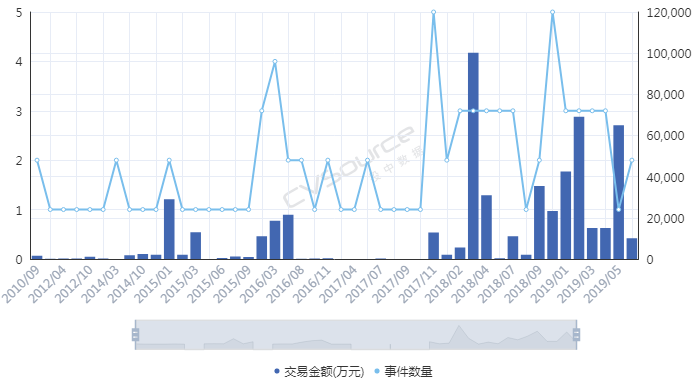
歷經(jīng)寒冬之后��,細胞免疫治療正在迎來資本的蜂擁而入��。今年以來����,截至9月20日,中國細胞免疫治療行業(yè)融資金額接近22億元�,已超去年全年,是2016年的5倍多�,更是2017年的近17倍,顯示資本熱情高漲����。此外���,這個月初��,擁有中國首款IND批件且為目前唯一獲準進入實體瘤治療2期臨床試驗細胞免疫治療產品的永泰生物擬赴港上市�,更是讓身在其中的企業(yè)和投資機構看到了希望����。投資人士認為,隨著全球兩款CAR-T產品獲批上市和國內政策監(jiān)管逐步規(guī)范化����,細胞免疫治療將迎來新的發(fā)展機遇。但是寒冬過后��,細胞免疫治療就會迎來春天嗎?目前�����,美國與中國是開發(fā)細胞免疫治療產品最為活躍的兩個國家��。美國專業(yè)期刊《Nature Reviews Drug Discovery》在今年5月發(fā)布的報告顯示��,美國與中國擁有獲批與在研的細胞免疫治療產品數(shù)量分別超過了400與300個����,合計約占總數(shù)的四分之三。該報告還指出���,中國目前的細胞免疫治療有47%由生物技術公司所開發(fā)�����,這一數(shù)字相較去年的38%有明顯增長�,中國的細胞免疫治療行業(yè)基本形成生物企業(yè)與科研院所平分秋色的局面����。這反映出中國細胞免疫治療產業(yè)的快速發(fā)展,背后當然也離不開資本的助力。據(jù)CVSources投中數(shù)據(jù)�����,自2018年以來資本快速涌入細胞免疫治療行業(yè)��。2018年全年融資事件達到22起的歷史最高�,涉及金額約21.07億元,相較2017年披露金額暴增超過15倍��;今年以來截至9月20日�,融資事件雖然僅有15起,但融資金額高達近21.66億元�,已超去年全年���,是2016年的5.33倍���,更是2017年的16.53倍。
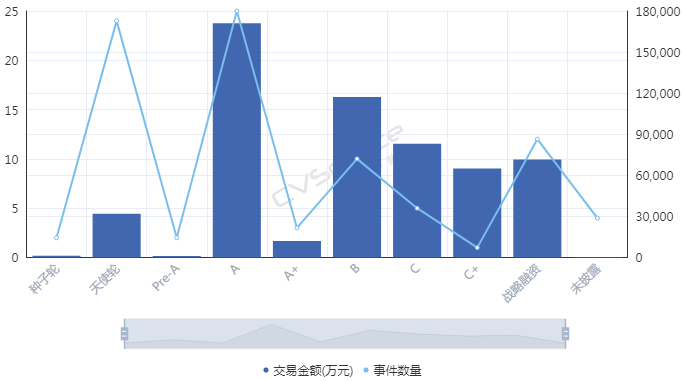
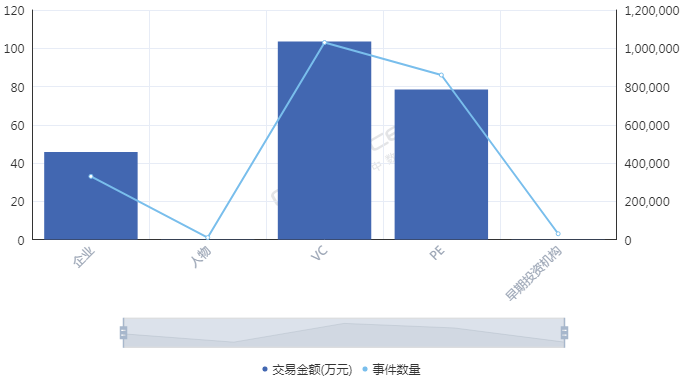
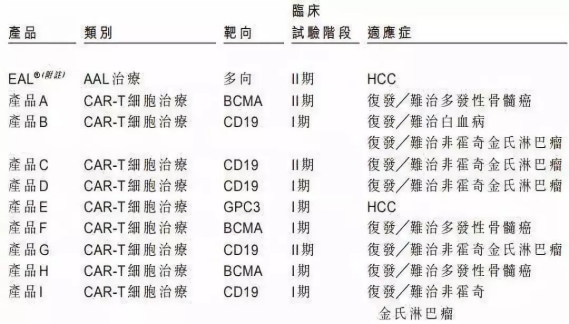
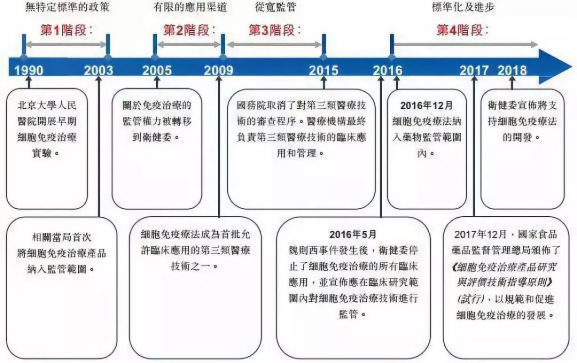
因為一起眾所周知的事件�����,細胞免疫治療在2017年遭遇資本寒冬�����。而后,直到2018年初前后�����,融資數(shù)量和金額才先后創(chuàng)出新高��。從融資進度來看���,近十年來進入細胞免疫治療行業(yè)的資本集中在A輪��,25起融資金額達到17.11億元�,B輪和C輪分別以11.72億元���、8.31億元位列其后����;天使輪雖然達到24起�����,僅次于A輪���,但融資總額僅有3.20億元��。這也間接顯示出細胞治療產業(yè)尚處于發(fā)展初期���,除了因遭遇寒冬之外��,在一定程度上也跟企業(yè)成立時間較短有關�,多數(shù)企業(yè)成立時間位于2013年以后���。那么��,哪路資本最熱衷于細胞免疫治療行業(yè)��?統(tǒng)計數(shù)據(jù)發(fā)現(xiàn)��,近十年來,VC和PE成為兩大投資主力�����,其中VC以103起��,103.53億元的投資金額名列前茅����,PE則以86起����,78.40億元的金額次之��;多家知名機構��,如淡馬錫����、軟銀中國資本、禮來亞洲基金���、鼎暉投資�����、君聯(lián)資本���、深創(chuàng)投等紛紛進場,不過這些機構多輪跟投的情況并不多見�。資本為何會在近兩年對細胞免疫治療行業(yè)表現(xiàn)出更大的興趣?高特佳投資集團創(chuàng)始人����、董事長蔡達建表示����,國際上CAR-T產品接連獲批上市和藥監(jiān)局細胞制品相關政策的發(fā)布�,意味著行業(yè)真正迎來了全新時代。高特佳曾在去年參與了上海斯丹賽生物技術有限公司B輪1.8億元的融資���,該公司成立于2009年����,主要從事細胞治療�����、干細胞和基因編輯等領域�����。此外�����,企業(yè)也是不可忽視的一支投資力量�,前述同期投資事件合計達到33起,合計投資規(guī)模45.81億元��。A股市場也一度形成了近20家上市公司組成的細胞免疫治療概念股��。與VC和PE等投資機構所不同的是����,企業(yè)進入細胞免疫治療行業(yè)還存在完善公司業(yè)務布局的意圖。此前耗資1.75億元參與上海細胞治療集團有限公司三輪融資的姚記科技就表示���,公司持續(xù)看好該公司發(fā)展前景���,同時這項投資也有利于完善公司產業(yè)鏈結構和布局。有意思的是��,在國內資本處于低谷的2017年���,卻被業(yè)界普遍視為細胞免疫治療的元年��。這一年的8月和10月�����,諾華制藥和凱特制藥的兩款CAR-T產品(分別為Kymriah���、Yescarta)先后獲得美國FDA批準上市���,意味著細胞免疫治療開啟商業(yè)化元年。這也使得全球對細胞免疫療法的熱情快速升溫�,其研發(fā)管線規(guī)模已在整個腫瘤免疫療法領域雄踞榜首,免疫療法甚至還被視為繼放化療�����、手術���、靶向治療之后的第四種抗癌方式���。據(jù)《Nature Reviews Drug Discovery》報告,截至今年3月�,全球范圍內共有1011款已獲批或正在研發(fā)之中的細胞免疫療法,相較去年同期增加258個��;其中CAR-T療法超過五成���,共有568款���,相較截至2018年3月增加164個,反映出業(yè)界對于CAR-T療法的巨大熱情��。除了首款和第二款CAR-T產品的上市����,美國制藥巨頭吉利德科學在2017年以現(xiàn)金119 億美元收購凱特藥業(yè),以及復星醫(yī)藥牽手凱特藥業(yè)�、獲得國內首個CAR-T療法臨床批件的南京傳奇和美國強生合作等等,都顯示出業(yè)界對細胞免疫療法的青睞����。據(jù)永泰生物招股書數(shù)據(jù),截至今年8月�,我國共有十種細胞免疫治療產品處于臨床,其中三款產品處于臨床2期�����,尚未有上市或提交NDA的細胞免疫治療產品�。值得一提的是,全球首款CAR-T產品Kymriah的臨床申請也已于今年8月獲得藥審中心受理�。截至今年8月我國處于臨床的十種細胞免疫治療產品 資料來源:永泰生物招股書細胞免疫治療遭遇追捧的背后是未來可期的市場空間。眾所周知����,癌癥已成為全球第二大死因�����,在中國則是第一大殺手�����。據(jù)世衛(wèi)組織報告��,2018年全球預計有1810萬癌癥新發(fā)病例和960萬癌癥死亡病例(全球所有年齡段��、性別�����,包括非黑色素瘤皮膚癌在內的所有癌癥發(fā)病比例的推算數(shù)據(jù))��;其中中國癌癥發(fā)病率���、死亡率居全球第一,在2018年全球癌癥新發(fā)病例和死亡病例中��,中國分別占到21%��、24%,且中國的癌癥治愈率遠低于美國等發(fā)達國家��。這些將為癌癥免疫治療未來的增長空間提供基礎���。正如巴黎第六大學的免疫學家 David Klatzammn 曾經(jīng)這樣公開評價:“細胞免疫療法是一個極其瘋狂的領域,競爭激烈��,未來發(fā)展值得期待��?��!?/span>據(jù)弗若斯特沙利文報告��,全球癌癥免疫治療市場規(guī)模將從2018年的206億美元達到2023年的755億美元���,中國將從人民幣19億元達到人民幣824億元;其中中國的細胞免疫治療市場規(guī)模預計將在2021年至2023年由人民幣13億元升至人民幣102億元����,隨著更多細胞免疫治療產品獲批,2030年將達人民幣584億元�,即2021年至2030年的復合年增長率高達近53%,增長可謂迅猛����。細胞免疫治療是癌癥免疫治療的主要類型之一(其他類型還包括檢查點抑制劑���、治療性癌癥疫苗、細胞因子治療等)���,通俗來講其治療機制是將患者血液或腫瘤組織的免疫細胞(多數(shù)為T細胞)提取出來��,通過技術手段裝上“GPS”后再注回患者體內���,從而對腫瘤細胞形成定位打擊。國內外諸多研究顯示����,免疫療法能夠提供相對持久和更高的緩解,在預防腫瘤復發(fā)方面具有顯著優(yōu)勢���,從而延長患者生存期��,同時在某些晚期癌癥患者中通常具有良好的安全性及有效性�,可以規(guī)避傳統(tǒng)的放化療�����、手術等方式的弊端(如放化療容易敵我不分造成正常細胞一定損傷從而引起多種毒副作用,手術對處理早期腫瘤存在局限性等)��。2013年癌癥免疫治療被《科學》雜志列為年度十大科學突破之首�����,美日兩名免疫學家也因在腫瘤免疫領域做出的貢獻而獲得2018年諾貝爾生理學或醫(yī)學獎��,無不顯示了業(yè)內對免疫療法的認可����。另外�����,增強抗腫瘤免疫力的聯(lián)合療法已經(jīng)成為整個癌癥界非常感興趣的領域�,但目前尚未有突破性進展。永泰生物在招股書中援引弗若斯特沙利文的報告稱�,預計中國細胞免疫治療的研究將進一步多樣化,除了將探索更多適應癥�����,開展免疫療法和其他療法的聯(lián)合治療也將會是一大趨勢����。研究表明��,與采用單一常規(guī)療法相比�����,聯(lián)合療法可以帶來更好的臨床效果��。不過���,細胞免疫治療仍面臨諸多挑戰(zhàn)和限制。首先必須看到��,細胞免疫治療雖然在部分腫瘤類型方面具有顯著療效�,但也存在B面。當下最為熱門的CAR-T療法曾經(jīng)挽救了患有急性淋巴性白血病的Emily Whitehead(世界上首個接受CAR-T療法的兒童)的生命�����,但其也存在細胞因子風暴����、神經(jīng)毒性和B細胞缺失等毒副作用。由于目前細胞免疫治療在臨床應用方面尚不普遍�,臨床試驗面臨患者數(shù)量限制�,部分腫瘤尤其是在實體腫瘤方面的有效性和安全性難以充分驗證��,國內大眾認知也不夠充分��。北京某三甲醫(yī)院專家表示�,雖然免疫治療在我國比較火熱,但患者往往是在傳統(tǒng)手段無法得到有效治療后才有可能進行嘗試��。近年來發(fā)生的多起相關死亡事件在一定程度上就暴露出細胞免疫療法在臨床應用和試驗階段的安全性問題���。其次����,細胞免疫治療并不是“萬能神藥”�。據(jù)前述專家介紹�,細胞免疫治療適應癥有限,國內外在許多實體腫瘤類型方面并沒有開展試驗��。然而數(shù)據(jù)顯示�,實體腫瘤占所有癌癥病例的比例超過90%,也就是說細胞免疫治療在最為核心的實體腫瘤領域發(fā)揮的效力有限�。永泰生物在招股書中也稱,CAR-T療法在白血病����、非霍奇金淋巴瘤等方面具有顯著功效����,但也存在治療后復發(fā)率較高��、實體瘤適應癥有限的局限性�。在國內處于臨床的十種細胞免疫治療產品中,僅有兩種用于治療實體瘤�,而有七種產品用于治療血液系統(tǒng)癌癥。同時�,從研發(fā)競爭情況看,目前細胞免疫療法主要集中在CD19靶向和CAR-T領域���,未來這可能會造成冗余和過度市場競爭�。據(jù)前述《Nature Reviews Drug Discovery》報告�����,目前全球共有142款療法針對CD19���,占據(jù)總數(shù)的14%�����,其中130款為CAR-T療法�;國內同樣也不例外,十種臨床產品中有九款為CAR-T細胞產品��,一半為CD19靶點�。細胞免疫治療未來若想有更大突破,還需在其他靶點和領域發(fā)力�。另外,價格也有可能會是一大痛點�。參考Kymriah和Yescarta分別高達47.5萬美元、37.3萬美元的費用��,昂貴的價格可能會讓許多患者望而卻步�。這些因素都會影響到細胞免疫治療的臨床應用和市場空間。監(jiān)管逐步規(guī)范 標準尚未統(tǒng)一對于資本而言�,吸引其進入細胞免疫治療這個行業(yè)的動力不僅在于可期的市場空間,另一大因素還在于趨于規(guī)范的行業(yè)監(jiān)管���。實際上,細胞免疫療法在中國雖然并不是新鮮事物�,國內已有約20年的經(jīng)驗,但長期存在法規(guī)盲點��,很大程度上阻礙了行業(yè)的規(guī)范發(fā)展和應用推廣�。2016年5月��,國家衛(wèi)計委(現(xiàn)為國家衛(wèi)健委)緊急叫停醫(yī)療機構在細胞免疫治療方面的臨床應用�����,僅允許其作臨床研究���,不得開展收費治療。當年12月�,國家食藥監(jiān)局(原CFDA,現(xiàn)為國家藥監(jiān)局)發(fā)布了《細胞制品研究與評價技術指導原則》(征求意見稿)��,首次明確提出將細胞免疫治療產品納入藥品監(jiān)管�;2017年底原CFDA正式發(fā)布《細胞免疫治療產品與評價技術指導原則》(試行),對其適用的細胞治療產品范圍進行了限定�����,并對細胞免疫治療產品的藥學研究����、非臨床研究、臨床研究等進行了規(guī)定��。業(yè)內人士認為���,這基本上明確了細胞免疫治療產品按照藥品監(jiān)管的路徑���,行業(yè)逐步進入從放到收的規(guī)范化軌道���。
細胞免疫治療的政策監(jiān)管變化 資料來源:永泰生物招股書盡管如此,關于細胞免疫治療的糾紛和爭議從未停止��。公開信息顯示���,僅僅是2017年國內就發(fā)生過兩起接受免疫療法的患者死亡的案例�。難以統(tǒng)一的監(jiān)管和標準被視為這一問題的根源�。2018年國家衛(wèi)健委宣布將支持開展醫(yī)療機構細胞免疫療法的臨床。今年3月底�����,經(jīng)國家藥監(jiān)局同意���,國家衛(wèi)健委發(fā)布了《體細胞治療臨床研究和轉化應用管理辦法(試行)》(征求意見稿)���,旨在規(guī)范和促進體細胞治療臨床研究及轉化應用���,意味著醫(yī)療機構開展細胞療法臨床研究并從事收費治療的大門有望重新開啟����。但是根據(jù)該管理辦法,醫(yī)療機構備案后即可進行臨床研究�、轉化應用即可收費、限定三甲醫(yī)院開展等規(guī)定引發(fā)業(yè)內貶褒不一�����,尤其是醫(yī)療機構相對寬松的監(jiān)管標準���,引發(fā)按照藥品監(jiān)管路徑而需要耗費更高成本的企業(yè)諸多不滿��。目前��,這一管理辦法尚未正式出臺實施�。可見����,目前對細胞免疫治療的監(jiān)管和標準尚未達成統(tǒng)一共識,細胞免疫治療的兩面性(即提取��、處理和回輸免疫細胞的過程可視為診療行為,但也可將在體外處理的細胞視為特殊的生物藥品)導致了定義的不同�����,進而決定了應用和監(jiān)管主體的差異�����。若定義為藥品����,則應由藥企主導,由藥監(jiān)部門監(jiān)管���;若定義為診療行為�,則應由醫(yī)院主導����,由衛(wèi)健部門監(jiān)管。明顯的是�����,關于細胞免疫治療的屬性依舊處于拉鋸狀態(tài)����,政策的天平同樣來回搖擺。但從目前的政策走向來看�����,細胞免疫治療行業(yè)將會形成藥企與醫(yī)院共同主導���、國家藥監(jiān)局與衛(wèi)健委雙軌監(jiān)管的格局���。這引發(fā)了擔憂,復星凱特生物科技有限公司CEO王立群此前曾公開表示��,“雙軌制監(jiān)管可能會導致行業(yè)質量標準以及臨床研究規(guī)范的混淆��,影響行業(yè)的規(guī)范化健康發(fā)展����。”他認為��,對于患者而言�����,只有在嚴格監(jiān)管下才能保障臨床的安全和有效。不過�,也有業(yè)內人士認為,雙軌監(jiān)管并不可怕����,關鍵是要做好分類,讓藥品的歸為藥監(jiān)部門��,讓醫(yī)療的歸衛(wèi)生部門�����,但必須統(tǒng)一監(jiān)管標準�。目前來看,統(tǒng)一監(jiān)管可能性不大�����,而統(tǒng)一標準或依舊尚需時日��。