近日�����,中國國家藥監(jiān)局藥品審評中心(CDE)最新公示��,羅氏(Roche)有兩款重磅新藥獲得臨床默示許可�。其中��,一款為腫瘤免疫療法阿替利珠單抗注射液(atezolizumab)���,適應(yīng)癥為聯(lián)合卡培他濱片用于不可切除的局部晚期或轉(zhuǎn)移性食管鱗狀細胞癌患者���。另一款為Baloxavir Marboxil(混懸顆粒劑和片劑兩種劑型),開發(fā)用于治療重癥住院的流感患者(年齡≥12歲)���。這兩款藥物均是羅氏旗下已在全球獲批的重磅新藥��,且備受關(guān)注�����。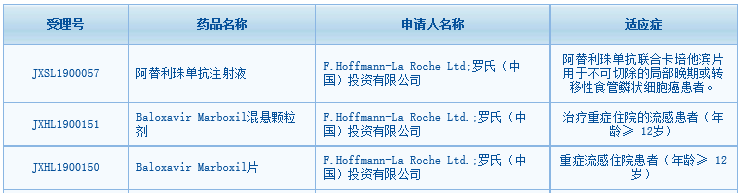
▲羅氏2款新藥獲得臨床默示許可(來源:CDE官網(wǎng)截圖)
阿替利珠單抗注射液是由羅氏開發(fā)的一款PD-L1腫瘤免疫治療藥物�。2016年5月�,該藥獲得美國FDA批準(zhǔn),用于膀胱癌的二線治療�,商品名為Tecentriq。同年10月��,該藥物被FDA批準(zhǔn)�,用于治療轉(zhuǎn)移性非小細胞肺癌患者(NSCLC)。2018年12月�,阿替利珠單抗與貝伐單抗、紫杉醇和卡鉑的組合療法再次獲得FDA批準(zhǔn)���,用于作為沒有EGFR或ALK基因變異的轉(zhuǎn)移性非鱗狀非小細胞肺癌(NSCLC)患者一線療法��,成為該藥獲批的一個重磅適應(yīng)癥��。

至2019年3月�,美國FDA再次批準(zhǔn)阿替利珠單抗聯(lián)合化療(卡鉑和依托泊苷)�����,用于廣泛期小細胞肺癌(ES-SCLC)的一線治療���。這是20多年來FDA首次批準(zhǔn)的唯一一個SCLC治療新手段�����,被認為是SCLC治療史上的里程碑事件���。根據(jù)羅氏財報��,Tecentriq在2018年創(chuàng)下了7.89億美元的銷售額��,同比增長率高達59.5%�����。在中國�,醫(yī)藥觀瀾查詢CDE網(wǎng)站和chinadrugtrials網(wǎng)站發(fā)現(xiàn)�����,羅氏已經(jīng)于今年2月在中國提交了阿替利珠單抗注射液的一項上市申請(受理號:JXSS1900004)���,但適應(yīng)癥未知��。同時該公司還提交了多項臨床申請和補充申請�,適應(yīng)癥包括肝細胞癌、非小細胞肺癌�、黑色素瘤和食管鱗癌等。2.Baloxavir Marboxil:20年來首個創(chuàng)新抗流感藥物
Baloxavir Marboxil是一款全新機制的抗病毒藥物���,由日本鹽野義制藥公司和羅氏聯(lián)合研發(fā)。2018年10月��,F(xiàn)DA批準(zhǔn)了該抗流感新藥上市���,用于治療12歲及以上無并發(fā)癥的急性流感患者�����,商品名為Xofluza�����。根據(jù)羅氏早前公告��,該藥物是首款也是目前唯一一款獲批用于治療流感的單劑量口服藥物�,也是FDA近20年來批準(zhǔn)的具有新型作用機制的首款抗流感病毒藥物��。

據(jù)悉�����,該藥作為單一口服劑量服用的抗病毒藥物,只需服用一次就可以見效��。其作用機制與目前已有抗病毒療法不同���,通過抑制流感病毒中的cap-依賴型核酸內(nèi)切酶�����,起到抑制病毒復(fù)制的作用���。與已有藥物相比,其靶向病毒復(fù)制周期的更早階段��,能夠治療對奧司他韋產(chǎn)生抗性的病毒株和禽流感病毒株�����。
該藥能夠獲批��,得益于其出色的臨床數(shù)據(jù)�����。臨床試驗表明,其僅需服用一次�,就能減少流感癥狀的持續(xù)時間,并在一天內(nèi)顯著減少病毒脫落��。該藥的2期��、3期試驗數(shù)據(jù)結(jié)果均支持了該藥物的獲批上市��。目前�,該藥已在多個國家獲批�����,包括在日本用于治療兒童���、青少年和成人的甲型和乙型流感�;在美國用于治療年滿12周歲兒童的急性��、無并發(fā)癥流感�。祝賀羅氏兩款重磅藥物在中國獲批臨床,期待這些創(chuàng)新藥能夠盡快取得好的臨床研究進展��,更好地造福更多患者。





